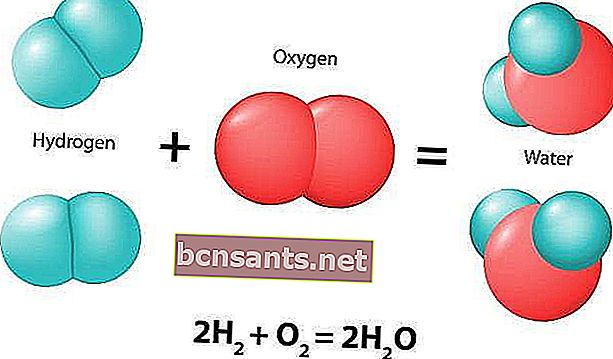
Una reazione chimica è un processo naturale che produce sempre cambiamenti nei composti chimici. Il composto oi composti iniziali coinvolti nella reazione sono chiamati reagenti.
Le reazioni chimiche sono solitamente caratterizzate da un cambiamento chimico e daranno luogo a uno o più prodotti che di solito hanno caratteristiche diverse dai reagenti. Ecco un esempio di reazione chimica:
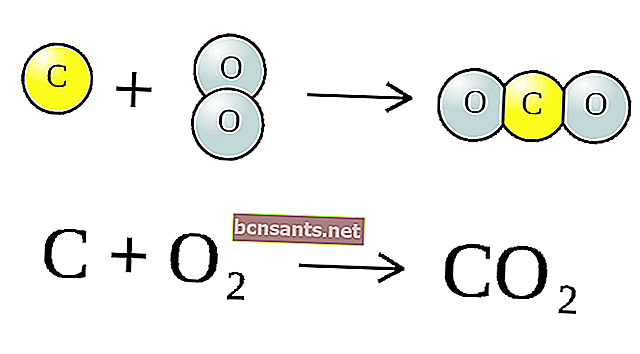
La reazione chimica sopra è una molecola (CO2) composta da un atomo di carbonio (C) e due atomi di ossigeno (O) più un carbonio (C), producendo 2 atomi di monossido di carbonio (CO).
La combinazione di questi simboli è chiamata equazione chimica . Le sostanze a sinistra della freccia sono chiamate per-reazioni (CO2) e C, e dopo la freccia sono chiamate i prodotti di reazione, cioè CO.
Caratteristiche di una reazione chimica
Le reazioni chimiche nel mondo reale sono molto facili da trovare, ad esempio quando si brucia la carta. La carta iniziale è ancora un foglio bianco, dopo averla bruciata col fuoco, la carta colorata viene bruciata.

Inoltre, quando facciamo bollire l'acqua. L'acqua liquida successiva diventa gas e vapore acqueo dopo essere stata bollita in una pentola che viene posta sul fornello.
Questi eventi sono un segno di una vera reazione chimica. Tuttavia, per la formazione del prodotto, il risultato è molto difficile da vedere. Ecco le caratteristiche di una reazione chimica:
1 . Scolorimento
Le molecole / composti chimici hanno la capacità di assorbire i colori ed emettere colore a seconda delle sostanze. Questa capacità può anche essere influenzata da un evento.
Ad esempio: i reagenti di ferro che vengono lasciati troppo a lungo all'aperto e allo stato umido arrugginiranno (giallo brunastro).
2. Cambiamento di temperatura
Le molecole / i composti chimici hanno energia interna sotto forma di legami chimici. Questi legami richiedono energia o possono rilasciare energia.
Quando si formano molti legami, l'energia viene rilasciata all'aumentare della temperatura. Ad esempio: bruciare gas GPL sul fornello
3. La comparsa di bolle di gas
I gas nelle reazioni chimiche possono verificarsi a causa del riscaldamento.
Ad esempio: le molecole / composti di bicarbonato di sodio nell'impasto quando riscaldati rilasceranno gas in modo che la torta si espanda.
4. Modifica del volume
Quando si formano i prodotti risultanti da una reazione chimica, significa che il volume dei reagenti viene ridotto. Ad esempio: il volume dell'acqua del lago diminuisce durante l'estate.
5. Formazione di sedimenti
Un precipitato è una reazione chimica residua tra due soluzioni che diventa solida. Questa sostanza può verificarsi perché la soluzione è troppo satura.
Ad esempio: la soluzione di nitrato d'argento (AgNO3) viene aggiunta a una soluzione contenente cloruro di potassio (KCl), si formerà un precipitato bianco di cloruro d'argento (AgCl).
6. Emissione di luce
Le reazioni chimiche a volte rilasciano energia sotto forma di luce
Ad esempio: reazione al sole
7. Cambiamenti nella conducibilità
Le reazioni chimiche influenzano i cambiamenti nella conduttività (capacità di condurre il calore).
8. Cambiamento di gusto
La reazione chimica durante la masticazione del riso crea un sapore dolce quando tocca la lingua.
Fattori che influenzano

La velocità di reazione o velocità in una reazione chimica indica il numero di reazioni chimiche che avvengono nell'unità di tempo.
Questa velocità è influenzata da diversi fattori che possono accelerare o rallentare il processo di reazione. Ecco i fattori.
1. Misurazione dei reagenti
Sale grosso o sale ancora a pezzi. Questo sale grosso si dissolve lentamente in acqua a causa delle sue grandi dimensioni. Quindi la reazione chimica dipende molto dalle dimensioni della sostanza.
Leggi anche: Domanda e offerta - Definizione, leggi ed esempi2. Temperatura
La temperatura può influenzare le reazioni chimiche, in particolare il riscaldamento. Ad esempio, in estate, le foreste di legname bruciano più velocemente che durante la stagione delle piogge.
3. Catalizzatore
Il catalizzatore è una sostanza che accelera la velocità delle reazioni chimiche a una certa temperatura, senza subire cambiamenti o essere consumata dalla reazione stessa. Gli enzimi sono un tipo di catalizzatore. Senza enzimi, questa reazione sarebbe troppo lenta per il metabolismo.
Ad esempio, l'enzima maltasi converte il maltosio (un tipo di polisaccaride o zucchero complesso) in glucosio. Di seguito è riportato uno schema generale di reazioni catalitiche, dove C rappresenta il catalizzatore:
A + C → AC (1)
B + AC → AB + C (2)
Fasi di reazione chimica
Le fasi di reazione possono essere facilmente suddivise in:
- Risoluzione dei legami,
- Formazione di composti di transizione
- Formazione del legame
Per i composti bimolecolari, i passaggi sono più complessi a causa della reazione elementare.
- Fase di inizio della reazione
- Risoluzione dei legami
- Formazione di composti di transizione
- Formazione del prodotto
- Stabilizzazione energetica (assorbendo o rilasciando energia / solitamente calore)
Miscellanea
Le reazioni chimiche sono molto diverse, ma possono essere classificate in diversi tipi di reazioni, vale a dire:
1. Reazione alla fusione
La reazione di due sostanze che si combinano per formare una nuova sostanza. Un semplice esempio è la formazione del sale NaCl: 2Na + Cl2 → 2NaCl
2. Decomposizione della reazione
Un composto che si verifica in una reazione chimica si scompone in più di due sostanze. Un esempio è la decomposizione dell'acqua H2O: 2H2O → 2H2 + O2
3. Reazione di scambio unico
Una reazione di scambio è una reazione in cui un elemento reagisce con un composto per sostituire gli elementi contenuti in quel composto. Ad esempio, se il rame viene immerso in una soluzione di nitrato d'argento, vengono prodotti cristalli metallici d'argento. L'equazione per la reazione è:
Cu (s) + 2Ag NO 3 (aq) → 2Ag (s) + Cu (NO 3 ) 2 (aq)
4. Molteplici reazioni di scambio
Di solito chiamata reazione di metatesi, è una reazione di scambio parziale dei reagenti. Se il reagente è un composto ionico laurtan, le parti scambiate sono i cationi e gli anioni del composto. Ad esempio, la reazione di acidi con basi come:
HCl (aq) + NaOH (aq) → NaCl (aq) + H 2 O (l)
5. Reazione di combustione
Questa reazione può essere nota come reazione per riorganizzare gli atomi. Uno dei reagenti contrassegnato è l'ossigeno.
Cioè, la reazione di combustione è una reazione chimica di una sostanza con l'ossigeno, che di solito reagisce più velocemente con il rilascio di calore fino a quando non appare una fiamma. Ad esempio bruciando metano
CH 4 (g) + 2O 2 (g) → CO 2 (g) + 2H 2 O (g)
Esempi di reazioni chimiche
Ci sono così tante reazioni da trovare nella vita reale. Alcuni sono deliberati sotto forma di praticantato in laboratorio in modo che si verifichi naturalmente.
Alcune di queste reazioni chimiche possono includere reazioni di incorporazione in nuovi prodotti, combustione, decomposizione e altre. Ecco alcune reazioni comuni:
1. Formazione di sapone

La reazione alberello è una reazione di idrolisi grasso / olio che utilizza una base forte come NaOH o KOH per produrre glicerolo e sali di acidi grassi o sapone. NaOH è usato per produrre sapone duro, mentre KOH è usato per produrre sapone morbido o sapone liquido.
La differenza tra sapone duro e morbido se vista dalla loro solubilità in acqua è che il sapone duro è meno solubile in acqua rispetto al sapone morbido. La reazione di saponificazione è anche chiamata reazione di saponificazione.

2. Reazione acido-base al sale
Leggi anche: 4 Principi di geografia e loro applicazione nella nostra vitaIn chimica, il sale è un composto ionico costituito da ioni positivi (cationi) e ioni negativi (anioni), che formano un composto neutro (senza essere caricato). Il sale si forma dalla reazione di acidi e basi. Il sale può anche essere formato da due diversi sali come:
Pb (NO 3 ) 2 (aq) + Na 2 SO 4 (aq) → PbSO 4 (s) + 2 NaNO 3 (aq)
3. Reazione di corrosione
La corrosione è il danno al metallo dovuto alla reazione redox tra un metallo e varie sostanze nel suo ambiente che producono composti indesiderati.
Nel processo di corrosione, il ferro (Fe) agisce come agente riducente e l'ossigeno (O2) disciolto in acqua funge da ossidante. L'equazione di reazione per la formazione della ruggine è la seguente:
Fe ( s ) → Fe2 + ( aq ) + 2e–
O 2 ( g ) + 4H + ( aq) + 4e– → 2H 2 O ( l )
4. Reazioni di fotosintesi
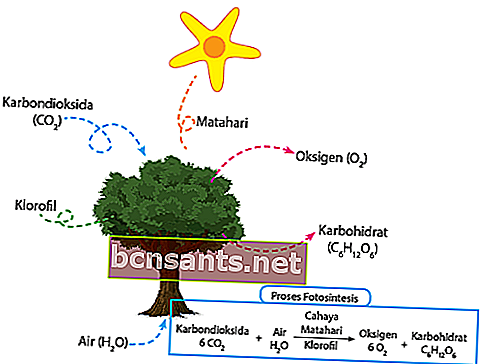
Secondo KBBI, il processo di fotosintesi è una pianta verde che utilizza la luce solare per convertire l'acqua e l'anidride carbonica in carboidrati. L'anidride carbonica che si trova intorno alla pianta viene assorbita direttamente attraverso il tessuto degli stomi nelle foglie. L'acqua che si trova intorno alla pianta viene assorbita direttamente attraverso le radici e passata alle foglie attraverso i fusti della pianta.
Proprio a mezzogiorno, l'intensità della luce che cade viene catturata direttamente dalla clorofilla per la fotosintesi. L'energia della luce solare che è stata catturata in precedenza convertirà direttamente l'acqua in ossigeno e idrogeno.
Infine, l'idrogeno che è stato prodotto verrà direttamente combinato con l'anidride carbonica per produrre cibo per le esigenze di queste piante. Il resto, l'ossigeno verrà rilasciato direttamente nell'aria attraverso gli stomi. Ecco l'equazione chimica:
6CO2 + 6H2O + luce = C6H12O6 + 6O2
5. Reazioni chimiche di aceto e bicarbonato di sodio
Ti è mai stato insegnato la reazione chimica se aceto e bicarbonato di sodio possono provocare un'eruzione vulcanica nella tua scuola?
I composti acidi mescolati con composti alcalini produrranno composti neutri. Nell'esperimento, un composto acido debole è stato miscelato in una soluzione di acido acetico (CH3COOH) con un composto base forte in una soluzione di bicarbonato di sodio (NaHCO3).

In una reazione chimica, una o più sostanze possono essere convertite in nuove sostanze, secondo l'esperimento, l'aceto acido (CH3COOH) viene fatto reagire con bicarbonato di sodio (NaHCO3) per produrre gas CO2.
Se l'aceto acido (CH3COOH) e il bicarbonato di sodio (NaHCO3) vengono fatti reagire, produrrà bolle che causano la formazione di anidride carbonica (CO2). Questi gas e liquidi causano la fuoriuscita di liquidi come la lava.
6. Reazioni chimiche enzimatiche
Gli enzimi sono biomolecole sotto forma di proteine che funzionano da catalizzatori (composti che accelerano il processo di reazione senza reagire completamente) in una reazione chimica organica.
Sebbene il composto del catalizzatore possa cambiare nella reazione iniziale, nella reazione finale le molecole del catalizzatore torneranno alla loro forma originale. Gli enzimi agiscono reagendo con le molecole del substrato per produrre composti intermedi attraverso una reazione organica che richiede un'energia di attivazione inferiore, in modo che le reazioni chimiche accelerino perché le reazioni chimiche con energie di attivazione più elevate richiedono più tempo.
Ad esempio: l'enzima catalasi è un enzima che catalizza una reazione in cui il perossido di idrogeno viene scomposto in acqua e ossigeno.
